Представителите на полската група от експерти за безопасност на използването на биологични терапии потвърдиха съгласието за интердисциплинарен консенсус по отношение на текущото състояние на научните познания в областта на безопасното използване на референтни и биоподобни биологични терапии.
На 10 януари 2019 г. във Варшава се проведе дебат. „Възможности и заплахи, свързани с терапията с биологични и биоподобни лекарства - перспективата на пациента, лекаря и платеца - знанията и консенсусът на А.Д. 2019 г. ".
Представителите на полската група от експерти за безопасност на използването на биологични терапии потвърдиха съгласието за интердисциплинарен консенсус по отношение на текущото състояние на научните познания в областта на безопасното използване на референтни и биоподобни биологични терапии.
Клиницистите призоваха представители на държавни агенции да подобрят правните и административни условия за по-добро прилагане на биологична и биоподобна терапия в Полша.
Представители на различни научни дисциплини участваха в дебата, иницииран от Полската група експерти по безопасността на биологичните терапии: проф. д-р хаб. Карина Янц-Рожик (алергология, клинична имунология), проф. Н. Мед. д-р хаб. н. мед. Ewa Lech-Marańda (хематология), проф. д-р хаб. н. мед. Марек Брзоско (ревматология), проф. д-р хаб. н. мед. Джоана Нарбут (дерматология), проф. д-р хаб. н. мед. Витолд Оучарек (дерматология), проф. д-р хаб. н. мед. Марек Рекас (офталмология), проф. д-р хаб. Ян Стичиньски (педиатрия), д-р Павел Ружановски, д-р (клинична онкология, клинична имунология), д-р Ева Więsik-Szewczyk (клинична имунология, ревматология), д-р хаб. Edyta Zagórowicz, доктор по медицина (гастроентерология).
Актуални знания
Експертите обобщиха състоянието на знания относно безопасността на използването на референтни биологични терапии и биоподобни терапии от 2014 г., когато докладът, озаглавен „Изложение на позицията на Полската работна група относно безопасността на биологичното третиране с моноклонални антитела и разтворими рецептори“, с позоваване на актуални научни данни.
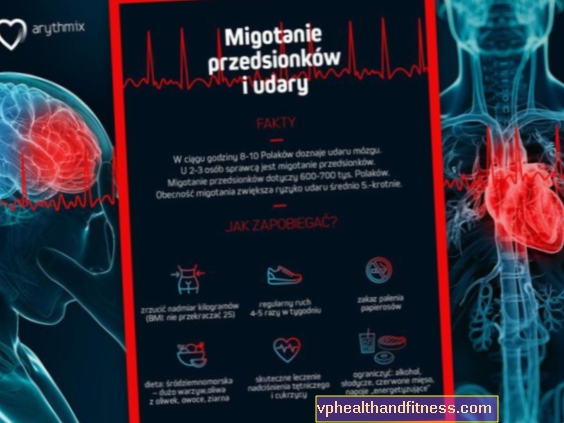
- Въвеждането на биологични терапии при лечението на заболявания от различни области на медицината, като ревматология, дерматология, хематология, алергология и онкология, се превърна в едно от най-важните постижения на съвременната медицина. През 2014 г., когато Полската група от експерти по безопасността на биологичните терапии разработваше първия доклад за възможностите и предизвикателствата в областта на ефективността и безопасността на референтните и биоподобни биологични терапии, не липсваха въпроси
и опасения относно тези терапии: безопасност и ефикасност на лечението по отношение на смяната на лекарства, имуногенност на терапията, правилна оценка на потенциалните странични ефекти. Днес, в началото на 2019 г., знаем много повече - решихме, че актуализирането на състоянието на знанията и интердисциплинарното споразумение е необходимо за отговорно, ефективно и безопасно лечение на пациенти с биологични референтни и биоподобни препарати в Полша - казва проф. д-р хаб. Карина Янц-Рожик, председател на Полската група от експерти за безопасност на биологичните терапии.
Интердисциплинарен консенсус
По време на работата по актуализиране на състоянието на знанията от последния доклад „Изложение на позицията на Полската работна група относно безопасността на биологичното лечение с моноклонални антитела и разтворими рецептори“ бяха обсъдени общо 14 въпроса, свързани с безопасността на биологичните терапии. По отношение на заключенията на групата и съвместните заключения, те бяха съгласувани и потвърдени в два кръга на гласуване.
Полската група експерти по безопасността на използването на биологични терапии стигна до заключението, че:
- Трябва да се очаква, че наличието на биологични биоподобни вещества значително ще намали разходите за биологични целеви терапии и следователно наличността на биологично лечение в Полша ще се увеличи. Това ще даде възможност за оптимизиране на използването на тези терапии в съответствие с международните препоръки (също като част от действащите програми за наркотици в Полша).
- Многоетапният процес на сравняване на структурата, функцията, фармакокинетиката, фармакодинамиката, имуногенността и ефикасността, препоръчани от регулаторните институции (Европейска агенция по лекарствата - EMA и Американската администрация по храните и лекарствата - FDA) е достатъчен, за да докаже (докаже) сходството на тестваното лекарство с оригиналния му аналог.
- Регистрираните биоподобни лекарства могат да се използват в същата степен като техните оригинални аналози по отношение на: индикации, противопоказания, монотерапия и комбинирана терапия.
- Наличните понастоящем резултати от изследвания потвърждават, че еднократното превключване между първоначалното лекарство и биоподобното лекарство е безопасно и не влияе върху ефективността на лечението.
- Заместването трябва да стане със знанието на лекаря и пациента.
- Знанията за биоподобните лекарства трябва да се разпространяват сред лекари, медицински работници и пациенти, за да се избегне ефектът на ноцебо, наблюдаван при замяна на оригинални лекарства с биоподобни.
- В избрани клинични ситуации и популации пациенти трябва да има възможност за оценка и мониторинг на имуногенността.
- Тъй като биоподобните лекарства и техните оригинални еквиваленти не се различават по структура, функция, фармакокинетика, имуногенност, потвърждаването на ефикасността и безопасността на биоподобно лекарство в едно показание е достатъчно за екстраполация на показанията.
Текущи предизвикателства
Както подчертаха експертите, въпреки общите заключения и новите научни и клинични познания, някои въпроси относно референтните биологични терапии и биоподобните терапии остават валидни, въпреки че няколко години след публикуването на последния доклад на Полската група от експерти по безопасността на биологичните терапии са известни повече. Един от актуалните въпроси е въпросът за многобройните лекарствени промени (смяна). През 2014 г. имаше опасения, наред с други неща, за ефективността на терапията с много различни лекарства, както и за възможните странични ефекти - как правилно да се оцени кое лекарство се отнася, как надеждно да се докладват и регистрират?
Полската група експерти по безопасността на използването на биологични терапии стигна до заключението, че:
- Наличните понастоящем резултати от изследвания са недостатъчни, за да се препоръчат множество замествания между оригиналното лекарство и биоподобното лекарство, въпреки че може да е приемливо в бъдеще.
- В областта на избраните лекарства, посочени като взаимозаменяеми, е допустимо автоматично заместване без участието на лекар.
- Това са предпазливи, но в същото време много важни заключения - коментира д-р Рафал Жиск от Института по управление на здравеопазването към университета Лазарски, член на полската група от експерти за безопасността на биологичните терапии. - Както беше посочено по време на работата по актуализирането на доклада от 2014 г., няма данни, които да оправдават препоръката за множество замествания между оригиналното и биоподобните лекарства, но, не на последно място, понастоящем няма нови данни, пораждащи съмнения в този контекст. Няма нови заплахи за безопасността на биологичната терапия с многократна смяна на лекарства. По-нататъшните изследвания и наблюдения през следващите години със сигурност ще донесат повече отговори - добавя д-р Рафал Жиск.
Необходимостта от регулаторни промени
Към дебата със заглавие „Възможности и заплахи, свързани с терапията с биологични и биоподобни лекарства - перспективата на пациента, лекаря и платеца - знанията и консенсусът на А.Д. 2019 ", бяха поканени представители на правителствени агенции, включително: Министерството на здравеопазването, Агенцията за оценка и тарифи на здравните технологии, Службата за регистрация на лекарствени продукти, медицински изделия и биоциди, Омбудсманът на пациентите, Полската аптечна търговска камара и Полското фармакоикономическо общество.
Представители на правителствени агенции се позоваха на заключенията, представени от Полската група експерти по безопасността на биологичните терапии:
- Понастоящем методът за наблюдение на ефективността и безопасността на биологичните терапии в Полша е недостатъчен.
- Необходимо е да се стандартизират инструментите за фармакологична бдителност на биоподобни лекарства, като се вземе предвид търговското наименование на лекарството и тяхното прилагане в ежедневната медицинска практика.
- Настоящите правни разпоредби, отнасящи се, inter alia, до информиране на пациента за метода на лечение, не вземат предвид спецификата на биоподобните лекарства и техните оригинални еквиваленти.
- Биоподобните са добра алтернатива на референтните лекарства и ефективно решение както за здравната система, така и за нейните бенефициенти: пациенти. Биоподобните терапии са решение, което изисква бързо прилагане на съществуващите законодателни инструменти, налични днес. Законът за възстановяване на разходи изрично задължава министъра на здравеопазването да включва както биоподобни, така и генерични продукти в списъка за възстановяване на разходите към тези, които вече са включени в първоначалните списъци с лекарства. Затова си струва да се запитате как да подобрите наличните законодателни инструменти, така че биологичното лечение с референтни и биоподобни препарати да е от полза за пациентите и държавния бюджет - коментира доктор по земеделски науки. Лешек Борковски, клиничен фармаколог в болница Волски.







.jpg)