Ензимите са от съществено значение за правилното функциониране на всички живи организми на Земята. Те участват в повечето, ако не и във всички химически трансформации в природата, тоест в милиони реакции както в растителния, така и в животинския свят. Струва си да разберете какво представляват ензимите, как действат и какво е тяхното значение за съвременната медицина.
Съдържание
- Ензими: Структура
- Регулиране на ензимната активност
- Ензими: Роля
- Ензими: Номенклатура
- Ензими и лекарства
- Болести в резултат на дисфункционални ензими
- Ензими: използване при диагностика
- Ензими и лечение
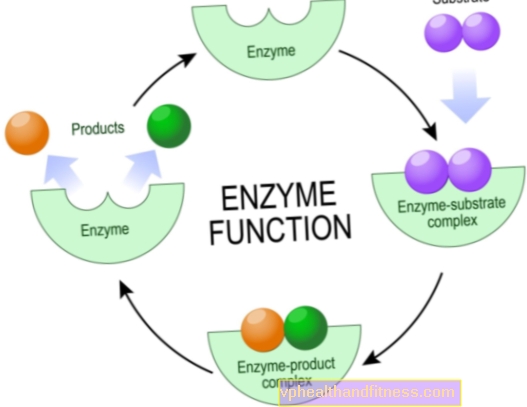
Ензимите са протеинови молекули, които ускоряват или дори позволяват протичането на различни химични реакции в живите организми, включително човешкото тяло.
От химическа гледна точка това са катализатори, т.е.частици, които усилват реакцията, но не се износват по време на реакцията. Това повишаване на ефективността на химичните трансформации често е огромно, естествените катализатори могат да съкратят времето за реакция от няколко години до няколко секунди.
Ензимите се намират във всички области на тялото: в клетките, в извънклетъчното пространство, в тъканите, в органите и в тяхната светлина, това, което катализаторите произвежда дадена тъкан, определя нейните специфични свойства и ролята, която тя играе в тялото.
Повечето ензими са много специфични, което означава, че всеки от тях е отговорен само за един вид химическа реакция, в която участват конкретни частици - субстратите и само те могат да взаимодействат с даден ензим.
Активността на природните катализатори зависи от много фактори: реакционната среда, например температура, рН, наличието на определени йони, активатори - те усилват действието на ензимите и инхибиторите, които противодействат на тази активност.
Ензими: Структура
Както споменахме, повечето ензими са протеини, те имат много разнообразна структура: от няколко десетки аминокиселини до няколко хиляди, подредени в разнообразна пространствена структура.
Това е формата на тяхното образуване (така наречената кватернерна структура) и фактът, че повечето ензими са много по-големи от реагентите на техните реакции, до голяма степен е отговорен за тяхната активност.
Това се дължи на факта, че само определена област в структурата на ензимите е така нареченото активно място, т.е. фрагментът, отговорен за провеждането на реакцията.
Задачата на останалите фрагменти от молекулата е да прикачат специфичен субстрат, по-рядко други съединения, които влияят върху активността на ензима.
Струва си да се знае, че структурата на катализатора е проектирана така, че съединяващият субстрат да е идеално съчетан от гледна точка на "ключ към ключалката".
Както всички протеини, ензимите се произвеждат в рибозомите от генетичния материал, който е плътно опакован в ядрото - ДНК, като по този начин се създава така наречената първична структура.
След това се прегъва няколко пъти - променя формата си, понякога добавя захари, метални йони или мастни остатъци.
Резултатът от всички тези процеси е образуването на активна четвъртична структура, т.е. напълно биологично активна форма.
В много случаи няколко ензимни частици се комбинират, за да осъществят поредица от химични реакции и по този начин да ускорят процеса.
Случва се в няколко тъкани да има ензими, които катализират една и съща реакция, но те структурно не си приличат, наричаме ги изоензими.
Имената на изоензимите са еднакви, въпреки разликата в местоположението и структурата, но тези разлики имат практическо приложение. По този начин е възможно да се определят в лабораторни тестове само онези ензимни фракции, които идват от определен орган.
Механизмите на действие на ензимите са разнообразни, но от химическа гледна точка тяхната задача винаги е да намалят енергията на активиране на реакцията. Това е количеството енергия, което субстратите трябва да имат, за да протече процесът.
Този ефект може да бъде постигнат чрез създаване на подходяща среда за провеждане на реакцията, като се използва различен химичен път за получаване на едни и същи продукти или подходящо пространствено разположение на субстратите.
Всеки от тези механизми може да се използва от ензимите.
Регулиране на ензимната активност
Действието на ензимите зависи от параметрите на околната среда: температура, pH и други. Всеки от естествените катализатори има своите оптимални характеристики при определени условия, които могат да бъдат значително различни в зависимост от неговата толерантност към условията на околната среда.
В случай на температура повечето ензимни реакции протичат по-бързо при по-високи температури, но при определена температура ефективността на реакцията рязко спада, което се причинява от термично увреждане на ензима (денатурация).
По отношение на тяхната структура хормоните могат да бъдат разделени на две групи:
- просто - това са само протеинови частици
- комплекс - които изискват прикрепването на непротеинова група - кофактор към тяхната активност
Последните играят ключова роля за правилната активност и регулиране на ензимите.
От своя страна кофакторите могат да бъдат разделени на две групи: тези, необходими за функционирането на ензима, силно свързани с него - това са така наречените протетични групи, те могат да бъдат метали, органични молекули, като например хем.
Втората група са коензими, те обикновено са отговорни за трансфера на субстрати или електрони и свързването им с ензима е слабо, тази група включва например фолиева киселина, коензим А. Струва си да се знае, че много витамини действат като кофактори.
Инхибиторите изпълняват съвсем различна задача, те са частици, които инхибират ензимната активност чрез свързване с ензима.
Има няколко вида инхибитори:
- необратими - те причиняват трайно инактивиране на молекулата и реакцията може да протече само след производството на нов ензим
- конкурентни - в този случай инхибиторът има структура, подобна на субстрата, така че те се конкурират за активното място. Ако е прикрепен инхибитор, реакцията се проваля, докато субстратът е нормален
- неконкурентен - такива инхибитори свързват ензима на място, различно от прикрепеното към субстрата, така че той може да се прикрепи към ензима, но реакцията не се осъществява
При много по-висока концентрация на субстрата от инхибитора, ефектът на конкурентния инхибитор се преодолява, тъй като той преодолява „конкуренцията“ за активното място, в случай на неконкурентна, неговият ефект не може да бъде преодолян чрез увеличаване на концентрацията на субстрата.
В допълнение към регулирането на активаторната и инхибиторната системи има много други методи за контрол на ензимната активност.
Те се отнасят до контрола на производството на клетките на нивото на образуване на протеини, както и до регулирането на така наречената посттранслационна обработка, т.е.промените в структурата на протеинова молекула, настъпващи непосредствено след нейния синтез в рибозомата. Тези модификации са например съкращаване на полипептидната верига.
Други методи за регулиране се отнасят до сегрегацията и разположението на ензимите в подходящи области: клетъчни и в специфични органели или в извънклетъчното отделение.
Има и друг важен регулаторен механизъм - отрицателна обратна връзка - това е основната система за контрол в ендокринната система. Работи на принципа на инхибиране.
Това означава, че ако ензимът произвежда твърде много от определен хормон, той се свързва с него, инхибирайки неговата активност и намалявайки синтеза, така че самият реакционен продукт инхибира производството му.
Ензими: Роля
Всяка тъкан на човешкото тяло произвежда специфичен набор от ензими, който определя ролята на тези клетки във функционирането на тялото. Кои са тези ензими се определя от генетичния код и кои региони са активни в дадена клетка.
По всяко време в човешкото тяло протичат хиляди химически реакции, всяка от които изисква специфичен ензим, така че би било трудно да се изброят всички тези частици, присъстващи в нашето тяло.
Струва си обаче да знаете за няколко от най-характерните:
- Храносмилателни ензими - произвеждани от тъканите на храносмилателната система, те разграждат храната до прости съединения, защото само те могат да се абсорбират в кръвта. Те са извънклетъчни ензими, така че те изпълняват основната си задача извън клетките, в които са произведени. Някои от тези ензими се образуват в неактивна форма, така наречените проензими или зимогени, и се активират в стомашно-чревния тракт. Храносмилателните ензими включват например амилаза, липаза, трипсин.
- Миозинът е ензим, намиращ се в мускулите, той разгражда молекулите на АТФ, които са енергийни носители, благодарение на което кара мускулните влакна да се свиват.
- Пероксидазите са окислителни ензими и каталази, т.е. редуциращи ензими
- Ацетилхолинестеразата е ензим, който разгражда ацетилхолин, един от пратениците в нервната система
- Моноаминооксидазата е ензимът, който е най-разпространен в черния дроб и е отговорен за разграждането на адреналин, норепинефрин и някои лекарства
- Цитохом оксидаза, много важен вътреклетъчен ензим, отговорен за енергийните промени
- Лизозим, вещество, присъстващо например в сълзи или слюнка, което изпълнява защитни функции, унищожава патогените
- Алкохол дехидрогеназа, ензим в черния дроб, който е отговорен за разграждането на етанола
- Алкална фосфатаза, участва в изграждането на костите от остеобластите
Ензими: Номенклатура
Имената на ензимите често са доста сложни, тъй като са получени от името на реакцията, която провеждат, и субстрата, участващ в тази реакция, например 5-хидрокситриптофан декарбоксилаза.
Обикновено суфиксът "-aza" се добавя към родовото име на реакцията, а втората част от името на ензима образува името на съединението, подложено на тази реакция.
Случва се името да е единично, тогава то идва от субстрат, например лактаза (ензим, който разгражда лактозата).
По-рядко имената на ензимите произтичат от общ процес, който протича с тяхно участие, например ДНК-гираза, ензим, отговорен за въртенето на ДНК-вериги.
Някои ензими в крайна сметка имат общи имена или имена, дадени от техния откривател, като пепсин (който разгражда протеините в храносмилателния тракт) или лизозим (бактерициден ензим, съдържащ се в сълзите).
Съществува и малка група рестрикционни ензими, които са отговорни за изрязването на ДНК веригите, в този случай името идва от микроорганизма, от който е изолиран ензимът.
Международният съюз по биохимия и молекулярна биология въведе правилата за именуване на ензимите и ги раздели на няколко класа, за да стандартизира номенклатурата.
Той не замества описаните по-рано имена, а по-скоро е допълнение към тях, използвано предимно от учените.
Съгласно правилата на Европейския съюз, всеки ензим се описва с поредица от знаци: EC x.xx.xx.xx - където първата цифра означава клас, следващи подкласове и подкласове и накрая номер на ензима. Споменатите ензимни класове са:
• 1 - оксидоредуктази: катализират реакциите на окисление и редукция
• 2 - трансферази: трансфер на функционални групи (напр. Фосфат)
• 3 - хидролази: съответстват на хидролизата (разлагането) на връзките
• 4 - лиази: разкъсват връзките по различен механизъм от хидролизата
• 5 - изомерази: те са отговорни за пространствените промени на молекулите
• 6 - лигази: свързват молекулите с ковалентни връзки
Ензими и лекарства
Значението на ензимите за човешкото здраве е огромно. Правилното им функциониране дава възможност за здравословен живот и благодарение на разработването на аналитични устройства се научихме да диагностицираме различни заболявания чрез определяне на ензима. Нещо повече, ние сме в състояние успешно да лекуваме дефицитите на някои ензими и произтичащите от това заболявания, но за съжаление има още много работа по този въпрос.
Понастоящем лечението на причините за метаболитни заболявания не е възможно, тъй като не сме в състояние безопасно и ефективно да модифицираме генетичния материал за възстановяване на повредени гени и по този начин неправилно произведени ензими.
Болести в резултат на дисфункционални ензими
Правилното функциониране на нашето тяло зависи до голяма степен от правилното функциониране на ензимите. В много случаи болестните състояния влияят върху количеството ензими, което води до тяхното прекомерно освобождаване от клетките или, напротив, недостиг.Следват само примери за заболявания, причинени от ненормални ензимни функции, има много повече от тях.
- Метаболитни блокове или метаболитни заболявания
Метаболитни блокове или метаболитни заболявания са група от наследствени заболявания, причинени от натрупването на вещества в клетката поради липсата на ензим, отговорен за техния метаболизъм. С времето се натрупват толкова много субстрати, че те стават токсични за клетките и целия организъм.
Тези заболявания са няколко хиляди, броят им отразява множеството ензими, открити в човешкото тяло, тъй като метаболитните заболявания могат да засегнат повечето гени, кодиращи ензимите.
Примери за това са галактоземия или хомоцистинурия, които са редки заболявания, проявяващи се най-често непосредствено след раждането или в първите години от живота.
- Тумори
Друга група заболявания, при които ензимната недостатъчност може да бъде свързана, е рак. В допълнение към много други функции, ензимите също са отговорни за регулирането на клетъчното делене, така наречените тирозин кинази. Ако тези ензими се провалят в тази област, може да възникне неконтролирано клетъчно делене и следователно неопластичен процес.
- Емфизем
По-рядко срещано заболяване е емфиземът, в който случай еластазата става свръхактивна. Това е ензим, присъстващ в белодробната тъкан, отговорен за разграждането на еластиновия протеин, присъстващ в белите дробове, наред с други.
Ако е твърде активен, балансът между разрушаването и изграждането се нарушава, възникват белези и се развива емфизем.
Ензими: използване при диагностика
Съвременната медицинска диагностика се основава на използването на ензими при определянето им. Това се дължи на факта, че болестните състояния директно или индиректно водят до дисбаланс на ензимите, причинявайки увеличаване или намаляване на количеството им в кръвта.
Това може да е резултат не само от производствени нарушения, но и например от освобождаването на голямо количество вътреклетъчен ензим в кръвта или урината в резултат на увреждане на клетъчната му мембрана.
Примери за ензими, използвани при лабораторни тестове, са:
- Креатин киназа - ензим, присъстващ в мускулите, също и в сърдечния мускул, многократното му увеличаване може да показва инфаркт, миокардит, мускулни заболявания - наранявания, дистрофия.
- Лактат дехидрогеназа - присъства във всички клетки на тялото, особено в мозъка, белите дробове, белите кръвни клетки и мускулите. Големият му ръст се наблюдава при инфаркти, мускулни и чернодробни заболявания или рак.
- Алкалната фосфатаза се намира най-вече в черния дроб и костите, тук се освобождава от остеобластите. Болестите на тези органи могат да причинят неговия растеж, но излишъкът от алкална фосфатаза може също да показва процеса на регенерация на костите - след операция или фрактура.
- Киселинната фосфатаза се среща в много органи - черен дроб, бъбреци, кости, простата, от диагностична гледна точка нейното увеличение може да показва костни и простатни заболявания.
- Аспартат аминотрансфераза и аланин аминотрансфераза - това са ензими, характерни за черния дроб, срещащи се почти изключително в хепатоцитите, те се използват при основната скринингова диагноза на чернодробни заболявания и тяхното неколкократно увеличение на стойността им винаги подсказва за по-нататъшна диагностика на чернодробни заболявания.
- Глутамат дехидрогеназата и гамаглутамилтрансферазата - други чернодробни ензими, подобно на гореспоменатите, са важни при диагностицирането на заболявания на този орган и жлъчните пътища.
- Амилазата е ензим, присъстващ в много органи, но най-висока концентрация се постига в клетките на панкреаса и слюнчените жлези, нейното диагностициране е от най-голямо значение при техните заболявания.
- Липазата е друг панкреатичен ензим, той се различава по специфичност от амилазата, което означава, че липазата присъства само в панкреаса и отклоненията от нормата при определянето на този ензим показват заболяване на панкреаса.
- Холинестеразата е ензим, който разгражда ацетилхолин - предавател в нервната система, където той също присъства в най-голямо количество, в диагностиката се използва при отравяне с фосфорорганични съединения.
- Фактори на коагулация и фибринолиза - това са вещества, произведени от черния дроб, участващи в съсирването на кръвта, техните определяния са важни не само при оценката на този процес, но и при проследяването на чернодробната функция.
- Алфа-фетопротеин - чернодробен ензим, чието количество се увеличава при заболявания на този орган, включително рак.
- С-реактивен протеин - произвежда се от черния дроб, участва в имунния отговор, количеството му се увеличава в кръвта при възпалителни състояния - инфекции, наранявания, автоимунни заболявания.
- Церулоплазмин - друг чернодробен ензим, увеличаването на който е характерно за болестта на Уилсън.
- Пиридинолин и дезоксипиридинолин са маркери за костна резорбция (разрушаване) и характеризират функцията на остеокластите (остеогенни клетки).
- Миоглобин - както споменахме по-рано, това е съединение, характерно за мускулите, така че увеличаването му ще показва увреждане на скелетните или сърдечните мускули.
- Тропонините - така наречените маркери за инфаркт, са ензими, които регулират свиването на мускулните влакна, особено много ги има в сърдечния мускул. Увреждането му причинява отделянето на големи количества тропонини в кръвта, което се използва при диагностицирането на сърдечни заболявания. Струва си да се помни обаче, че увеличаването на тропонините може да показва не само инфаркт, но и неговата недостатъчност, клапни дефекти или белодробна емболия.
Всички изброени по-горе ензими могат да бъдат класифицирани в няколко групи:
- Секреторни ензими - долната граница на нормата е диагностична. Това са ензими, които се произвеждат физиологично от органи, но в случай на заболявания техният брой намалява, например фактори на съсирването
- Индикаторни ензими - растежът е важен. Тази група ензими се появява в големи количества поради увреждане на органи и изтичане на ензими, те включват например тропонини
- отделителни ензими - това са ензими, произвеждани нормално в лумена на различни органи - устата, червата и пикочните пътища. Ако изходът им е блокиран, те попадат в кръвта, например амилаза
Струва си да се помни, че ензимите се използват в самата медицинска диагностика. Биохимичните анализи се извършват с използване на ензими и подходящото тълкуване на резултатите от ензимните реакции позволява да се предостави резултат от лабораторен тест.
Ензими и лечение
Много лекарства действат, като влияят на действието на ензимите, или като ги карат да действат, или, напротив, като са инхибитори. Има ензимни заместители като панкреатин, съдържащ липаза и амилаза за панкреатична недостатъчност.
От друга страна, някои групи лекарства инхибират действието на ензимите, например инхибитори на ангиотензин-конвертиращия ензим, използвани, наред с други, при хипертония и сърдечна недостатъчност, или някои антибиотици, например амоксицилин, който инхибира ензима бактериална транспептидаза, който предотвратява изграждането на бактериалната клетъчна стена и по този начин инхибира инфекция.
Някои отрови действат и чрез въздействие върху ензимите. Цианидът е мощен инхибитор на цитохром оксидазата, съществен компонент на дихателната верига. Блокирането му предотвратява получаването на енергия от клетката, което води до нейната смърт.
За правилното протичане на жизнените процеси на клетките е необходимо наличието на много химически вещества, оставащи в строги пропорции помежду си, и между които непрекъснато протичат химически реакции.
Тази задача се изпълнява от правилно функциониращи ензими, които са необходими, за да протича почти всяка химическа реакция със скоростта и ефективността, необходими за правилното функциониране на човешкото тяло.
Действието на ензимите ускорява тези процеси многократно, често дори стотици пъти, което е важно, самите ензими не се износват по време на протичащите реакции.
Липсата на катализатори или тяхното неподходящо функциониране може да доведе до появата на много заболявания. От друга страна, умелото модифициране на тяхната дейност ви позволява успешно да лекувате много заболявания.
Ензимологията (науката за ензимите) е изключително обширна и нейното развитие може да донесе не само научен прогрес, но и да допринесе активно за развитието на медицината по отношение не само на лечение, но и на диагностика.
За автора